Un universo pequeñito e invisible
Un universo pequeñito e invisible
Aprendizaje esperado: explora algunos avances recientes en la comprensión de la constitución de la materia y reconoce el proceso histórico de construcción de nuevas teorías.
Énfasis: explicar cómo ha evolucionado el concepto de modelo atómico a lo largo de la historia.
¿Qué vamos a aprender?
Explorarás cómo está conformada la materia e identificarás las teorías que han llevado a construir este conocimiento. Además, conocerás qué es el átomo y sus características.
¿Qué hacemos?
Responde las siguientes preguntas:
- ¿Qué es lo más pequeño que has visto en tu vida?
- ¿Piensas que eso es lo más pequeño que existe?
Escriban las respuestas en su cuaderno.
La idea de saber ¿qué es lo más pequeño que existe? ha sido una pregunta que se ha hecho el ser humano desde hace siglos.
Para entender desde cuándo se ha hecho esta pregunta, debes empezar con una civilización que tuvo su origen en la antigua Grecia. Gran parte de nuestra cultura se debe a ellos. En esta civilización se desarrollaron las matemáticas, el derecho, la filosofía, la historia, la medicina, la geografía. Ahí se originaron los juegos olímpicos y tuvieron gran auge las artes, en especial el teatro y la escultura.
Lo más importante, fue que se desarrolló una forma racional de pensar, que buscaba una explicación de los fenómenos, separándola de creencias y dogmas.
Una de las cuestiones que intrigaba a los antiguos pensadores griegos era la naturaleza de las cosas. Saber de qué estaban hechas y cuál era su origen.
Leucipo y Demócrito llegaron a la conclusión de que, en algún momento, cada objeto que se dividiera tendría que llegar a una partícula tan diminuta que no podría dividirse más y a eso le llamaron átomo, una palabra griega que significa “indivisible”.
Ahora se sabe que todo está formado por átomos, partículas muy pequeñas que son imperceptibles al ojo humano.
A continuación, realiza una representación de las ideas de Leucipo y Demócrito.
Leucipo y Demócrito decían que se obtenía un átomo cuando cortaras un material una y otra vez sucesivamente, hasta que llegaras al punto donde no se pudiera dividir más.
Vas a replicarlo con una hoja de papel.
Tómala y rómpela hasta que ya no puedas dividirla más.
Según las ideas de Leucipo y Demócrito, eso sería un átomo de una hoja de papel. Cabe mencionar, que los filósofos griegos no hacían experimentos para comprobar sus hipótesis, ya que todo lo desarrollaban por medio del razonamiento lógico. Pero sus ideas sirvieron de fundamento para los investigadores experimentales posteriores a ellos.
Toma en cuenta las células, que son tan pequeñas que no se pueden ver a simple vista, incluso se necesita un microscopio para observarlas, y éstas, como toda la materia que nos rodea, está constituida por átomos. Imagina qué tan pequeños son los átomos.
Los átomos comparados con las células son aproximadamente diez billones de veces más pequeños, dependiendo del tipo de célula.
Hoy en día, se dice que el átomo es la unidad más pequeña de la que puede estar constituido un elemento químico. Cada sólido, líquido, gas o plasma se compone de átomos.
Con el paso del tiempo, los científicos han aportado más evidencias que establecen un modelo atómico donde el átomo no es indivisible ni lo más pequeño que existe.
Un modelo en la ciencia es una representación de sistemas o procesos científicos, los cuales tienen el fin de analizar, describir, explicar o predecir algún fenómeno.
Los modelos atómicos, son una representación gráfica o simbólica de los átomos, que permiten describir cómo se comportan y organizan.
Para conocer algunos modelos que realizaron distintos científicos a lo largo del tiempo para representar el átomo hasta llegar al modelo actual, observa el siguiente video.
- El átomo.
https://www.youtube.com/watch?v=1OQYgCvaOsc
Muchos siglos después de Leucipo y Demócrito, en 1803 llegó un científico británico llamado John Dalton, que imaginó que los átomos eran como esferas compactas con tamaños y masas diferentes y enunció tres postulados.
Dijo que:
- Los elementos están formados por partículas muy pequeñas llamadas átomos, que son indestructibles e indivisibles.
- Todos los átomos de un elemento son iguales y poseen el mismo peso, mientras que los átomos de distintos elementos, además de ser diferentes, tienen distintos pesos.
- Los átomos se pueden unir para formar compuestos.
El científico Joseph Thomson, en 1909 realizó experimentos con un tubo de rayos catódicos, los cuales le permitieron ver que existían partículas negativas dentro del átomo, a las que llamó electrones.
Pero también sabían que el átomo no tenía carga, así que, para neutralizar esas partículas, necesitaba haber cargas positivas.
En su modelo, proponía que el átomo era una esfera de carga positiva y que los electrones estaban metidos en ella, como las pasas en un panqué; por eso, se le conoce como el modelo atómico del “panqué de pasas”.
Después de que Thomson propusiera este modelo, la idea de Dalton de que el átomo es indivisible quedó obsoleta, ya que fue descubierto el electrón.
En el año de 1911, el científico Ernest Rutherford que, al hacer experimentos con una lámina de oro, descubrió que el átomo tiene una parte en el centro donde concentra casi toda su masa, y tiene carga positiva, a ésta le llamó núcleo.
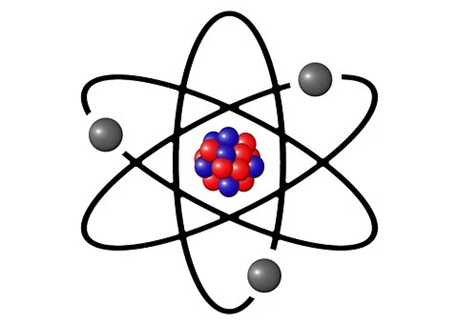
También con sus experimentos se teorizó que existía un par de partículas más que componían el núcleo de los átomos, una con carga positiva a la que se le llama protón, y otra sin carga, el neutrón. Y que alrededor de ellos, se encuentran girando los electrones con carga negativa. A su modelo se le llamó, modelo atómico planetario.
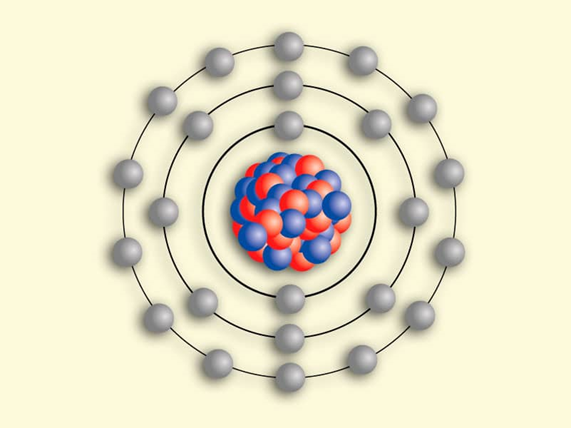
En 1913, Niels Bohr, que era alumno de Rutherford, continuó con los experimentos y propuso que los electrones se desplazaban alrededor del núcleo como un pequeño sistema planetario, y enunció tres postulados.
- Los electrones se mueven alrededor del núcleo en trayectorias definidas llamadas órbitas.
- A cada órbita le corresponde un nivel específico de energía.
- Los electrones se pueden mover de un nivel a otro si absorben o emiten energía.
El modelo atómico más reciente, se construyó a partir de la mecánica cuántica, y con aportaciones de varios científicos. La mecánica cuántica es la teoría que nos dice cómo se comporta la materia a niveles subatómicos, es decir, dentro de los átomos.
En los modelos anteriores se proponía que los electrones se movían muy parecido a como lo hacen los planetas alrededor del sol, ahora se interpretan con ayuda de la probabilidad.
Los electrones se pueden encontrar en ciertas zonas permitidas dependiendo de la energía que tengan, y estos lugares ya no son órbitas.
Es un modelo matemático muy complejo y sólo se ha explicado ampliamente para el átomo de hidrógeno. Para elementos más complejos se hacen aproximaciones matemáticas.

Por lo tanto, la Física no está compuesta por leyes que no cambian. A lo largo de la historia, se han descubierto nuevas cosas que vienen a revolucionar lo que se conoce. La ciencia está en constante cambio.
Recapitulando, el átomo es la unidad más pequeña con la que están formados los elementos, son divisibles porque están formados de partículas cargadas. Las cargas positivas junto con las neutras se encuentran en el núcleo del átomo, mientras que los electrones están en regiones permitidas por sus niveles de energía, alrededor del núcleo.
No olviden que, si tienes dudas o quieres investigar más, puedes consultar tu libro de texto o fuentes de información confiables.
El reto de hoy:
Después de toda la información que has revisado en esta sesión, retoma las preguntas del inicio.
- ¿Qué es lo más pequeño que has visto?
- ¿Piensas que eso es la cosa más pequeña que existe?
Compara lo que escribiste con lo que ahora sabes. Y complementa tus respuestas si crees que es necesario.
Realiza una línea de tiempo, ilustrando los modelos atómicos más representativos en la historia, o bien, puedes recrear un modelo atómico.
Si tienes alguna duda, puedes buscar información en tu libro de texto, o también investigar en páginas confiables de Internet.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas
https://www.conaliteg.sep.gob.mx/