¿Qué cambia y qué permanece en una reacción química?
¿Qué cambia y qué permanece en una reacción química?
Aprendizaje esperado: verifica la correcta expresión de ecuaciones químicas sencillas con base en la ley de conservación de la materia.
Énfasis: explicar y verificar la correcta expresión de ecuaciones químicas sencillas con base en la ley de conservación de la materia a partir de actividades experimentales.
¿Qué vamos a aprender?
Lee la siguiente frase célebre de Albert Einstein:
“La imaginación es más importante que el conocimiento. El conocimiento es limitado y la imaginación circunda el mundo”.
En las reacciones químicas algo cambia y algo permanece.
El propósito de esta sesión es explicar y verificar la correcta expresión de ecuaciones químicas sencillas con base en la Ley de Conservación de la Materia, a partir de actividades experimentales.
Las explicaciones se dan desde un enfoque químico y, se expresará por medio de símbolos y fórmulas a los elementos y a los compuestos que participan en una reacción para posteriormente representarlos en una ecuación química, así como en modelos.
Los materiales que utilizarás son tu cuaderno, tu libro de texto de Ciencias. Química, tu tabla periódica de los elementos químicos, bolígrafo, lápiz y colores.
¿Qué hacemos?
Es interesante e inquietante reflexionar y analizar cómo contribuye o impacta la química en el mejoramiento de la calidad de vida.
Todos los días en tu rutina ocurren una infinidad de cambios como: La fotosíntesis, la respiración, la descomposición de la leche o de una fruta, el encender un cerillo, los ingredientes que se mezclan y cocinan para preparar un pan, entre otros.
Cuando se observan cambios al reaccionar algunas sustancias, se debe a que se transforman en otras. Si pudieras observarlos submicroscópicamente, te darías cuenta de que sus átomos se reacomodan.
Antes de comenzar, reflexiona las siguientes preguntas:
¿Qué es una reacción química?
¿Qué es una ecuación química?
¿Cómo aplicas la Ley de conservación de la materia en una ecuación química?
Una reacción química ocurre cuando en una o más sustancias se han separado los átomos debido al rompimiento de enlaces y la formación de otros, lo que resulta en nuevas sustancias; esto puede ser por un cambio en el tipo o número de átomos en la sustancia, o por un cambio en la estructura o configuración de estos átomos.
Una ecuación química es una representación que utiliza símbolos y fórmulas químicas para describir las identidades y cantidades relativas de los reactivos y los productos involucrados en una reacción química.
Los reactivos y productos son sustancias diferentes, por lo que tienen propiedades distintas: Composición química, temperatura de fusión, densidad, viscosidad, estado de agregación y color.
Las ecuaciones químicas permiten:
- Expresar mediante símbolos y fórmulas una reacción química.
- Mostrar las sustancias que reaccionan y las que se producen.
- Indicar la cantidad de materia de las sustancias que intervienen en una reacción química.
Los alquimistas del siglo XVII no prestaban atención al aspecto cuantitativo de la ciencia; mezclaban sustancias, observaban y describían sus polvos y sus gases, pero no los median, no les preocupaba que esas sustancias ganaran o perdieran masa de forma sorprendente durante sus transformaciones ya que, para los primeros químicos, eso parecía tener poca importancia.
Luego apareció un hombre que declaró que la medición era lo más importante, pues debe ser la base de todos los experimentos químicos. Este hombre es considerado ahora el padre de la química: Antonie Laurent Lavoisier.
Lavoisier enuncio la Ley de la Conservación de la Materia: “La materia no se crea ni se destruye, sólo se transforma”.
Durante una reacción química, los átomos no se crean ni se destruyen, sólo se reordenan para formar los productos. No aparecen nuevos átomos, ni desaparece alguno de los átomos de las sustancias originales.
Recuerda que cuando se lleva a cabo una reacción química, la cantidad de masa (materia) de las sustancias reactantes es igual a la cantidad de masa (materia) de las sustancias formadas.
Por ejemplo, en la siguiente reacción:

Del lado de los reactivos se tienen una molécula de hidrógeno formada por dos átomos, y del lado de los productos, también dos átomos de hidrógeno; sin embargo, del lado de reactivos se tiene una molécula de oxígeno formada por dos átomos, y del lado de productos sólo un átomo de oxígeno, por lo que no se cumple con la Ley de la Conservación de la Materia.
Ante esto, se modifica la ecuación y se agregan coeficientes estequiométricos donde se necesite sin cambiar los subíndices en las fórmulas, quedando de la siguiente manera:
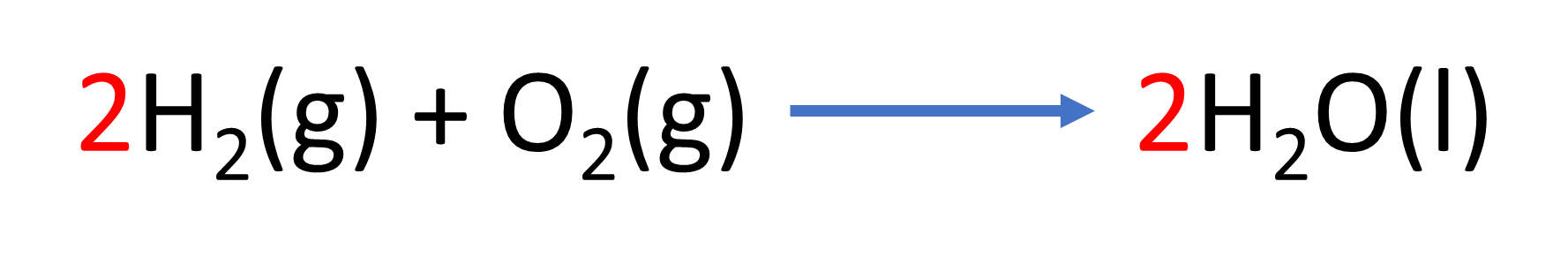
Ahora sí, de cada lado de la ecuación se tienen cuatro hidrógenos y dos oxígenos: La ecuación ya está balanceada.
El coeficiente estequiométrico que precede a una fórmula química es una instrucción de multiplicar todo lo que hay en la fórmula por ese número, como en una ecuación matemática. Cuando no aparece ningún número, se sobreentiende que el coeficiente es uno.
En la ecuación anterior, del lado de los reactivos, el coeficiente 2 multiplica al hidrógeno molecular H2, quedando cuatro hidrógenos; el oxígeno molecular O2 tiene el coeficiente uno y queda como dos oxígenos. Del lado de los productos, el coeficiente 2 multiplica a los dos átomos del hidrógeno H2 y al oxígeno O, quedando cuatro hidrógenos y dos oxígenos.
Una ecuación química no está completa en tanto no esté balanceada.
En este caso, la ecuación cumple con la Ley de la Conservación de la Materia y por lo tanto está balanceada.
¿Sabías qué? Para que se lleve a cabo esta reacción química se necesitan dos sustancias, una llamada combustible y otra que es el comburente, que generalmente es oxígeno del ambiente. Es la combustión.
Son muchas las reacciones que de manera continua y cotidiana suceden y se pueden identificar. Algunas fácilmente, gracias a las manifestaciones que suceden, por ejemplo, un cambio de color, liberación de gas (efervescencia), liberación de energía (luz o calor) o formación de un precipitado, por mencionar algunos.
Dicho esto, realiza la siguiente actividad.
Ponte tu bata, guantes y careta, que la ciencia te despierta.
¿Qué necesitas?
- Botella
- Levadura de panificación
- 1 globo
- Azúcar de mesa
- Agua tibia
- Balanza
¿Cómo lo harás?
Vierte agua tibia en la botella, agregas la levadura y agita; esto para que comience a activarse la levadura. Posteriormente agrega azúcar.
Coloca el globo en la boca de la botella y lo colocas en la balanza para saber la magnitud de la masa.
Observa qué es lo que sucede con el globo y registra la magnitud de la masa.
Lo que se observa es un ejemplo de una reacción química, pero ¿Qué cambió? Cambió el color, el estado de agregación, y hubo desprendimiento de gas.
¿Qué permaneció en esta reacción química? La masa permaneció constante.
Pasa a la siguiente actividad.
¿Qué necesitas?
- Agua oxigenada o peróxido de hidrógeno (H2O2)
- Yoduro de potasio
- Un vaso de vidrio o matraz
- Termómetro
¿Cómo lo harás?
Coloca el agua oxigenada en el matraz, toma la temperatura, y agrega de 1 a 2 gramos de yoduro de potasio.
Observa lo que sucede, la reacción es cada vez más acelerada y hay formación de burbujas de gas. Vuelve a tomar la temperatura. Anota el registro de la temperatura inicial y final en tu cuaderno.
¿Qué sucedió en esta reacción?
Las burbujas que observas en el matraz se formaron por el oxígeno liberado por la descomposición del peróxido de hidrógeno, el yoduro de potasio que agregaste en el matraz sirve para acelerar esta reacción de descomposición, la cual es exotérmica, ya que existe la liberación de calor.
Compara las temperaturas antes y después de la reacción.
Lo que ocurrió en esta reacción química se representa mediante la siguiente ecuación química:

Contesta la siguiente pregunta:
¿Qué cambió?
Registra lo que se observó.
En tu cuaderno copia y completa la siguiente tabla con la información que proporciona la ecuación química de la reacción que acabas de aprender; el yoduro de potasio sirve como catalizador en esta reacción.
Un catalizador acelera una reacción, sin embargo, no es uno de los reactivos que intervienen en la misma.
Ya que observaste la ecuación química de esta reacción ¿se cumple con la Ley de la Conservación de la Materia?
Revisa:

Al observar la ecuación química escrita de esa manera te das cuenta de que existe una diferencia en la cantidad de átomos que reaccionaron y la cantidad de átomos que se produjeron, por lo que no se cumple la Ley de Conservación de la Materia.
Por ello, tendrás que realizar un balance de la ecuación química, es decir, colocar coeficientes estequiométricos tal que la cantidad de átomos presentes en los reactivos, sea igual a la cantidad de átomos presentes en los productos.
Colocarás un 2 en la molécula de peróxido de hidrógeno y un 2 en la molécula de agua en los productos.
Verifica si la expresión de la ecuación química es correcta:

Tienes 4 átomos de hidrógeno de lado de los reactivos y 4 átomos de hidrógeno en los productos de las 2 moléculas de agua, también tienes 4 átomos de oxígeno en reactivos y 4 átomos de oxígeno en productos.
De esta manera se está cumpliendo con la Ley de la Conservación de la Materia.
Ahora responde las siguientes preguntas:
¿Qué cambió en esta reacción química?
Cambió la apariencia de los reactivos, la temperatura, y hubo desprendimiento de gas.
¿Qué permaneció?
Permanecieron los átomos que participaron en ella, solo que ahora tienen enlaces diferentes.
Hubo formación de enlaces nuevos, y después del balanceo que se realizó, puedes afirmar que también permanece la masa por lo que se cumple con la Ley de la Conservación de la Materia.
Ahora pasa a otro ejemplo de la vida cotidiana. Es el uso de un encendedor: En la flama que genera se utiliza un gas llamado propano, que reacciona con el oxígeno que se encuentra en el ambiente mediante la siguiente ecuación.

Lee la ecuación química: Puedes darte cuenta de que el primer compuesto de los reactivos no tiene ningún coeficiente.
Se tiene una molécula de propano en estado gaseoso reacciona con 5 moléculas de oxígeno en estado gaseoso, producen tres moléculas de dióxido de carbono en estado gaseoso y cuatro moléculas de agua en estado gaseoso y calor.
Entonces, al liberar calor, se puede decir que esta es una reacción exotérmica. ¿Cómo aplicas la ley de conservación de la materia en una ecuación química?
En este caso, es muy sencillo demostrarlo, y lo que necesitarás es representarlo por medio de un modelo tridimensional con unas esferas y palillos, para que al concluirlo se pueda explicar de mejor forma, así que representa la ecuación química.
Realízalo con colores en tu cuaderno respetando los colores de cada elemento según el código CPK.
Tomas tres esferas de color negro que serán el carbono y las unes con apoyo de un palillo; recuerda que el carbono que está en la familia 14 tiene 4 electrones de valencia. Ahora coloca en esos espacios los hidrógenos representados por esferas de color blanco; como el primer carbono ya ocupó un enlace le quedan libres tres, colocas en cada uno otra esfera de diferente color que represente al hidrógeno, observa que el segundo carbono sólo necesita dos hidrógenos porque ya tiene dos enlaces con cada carbono.
Como puedes darte cuenta, el tercer carbono es igual al primero y terminas el modelo tridimensional.
Ahora tomas dos esferas de color rojo, que representa la molécula diatómica del oxígeno, y construye su modelo como lo indica la ecuación, pero ¿sabea cuántas moléculas tienes que hacer de oxígeno?
Son cinco, recuerda que debes considerar 10 esferas porque es una molécula diatómica.
Ahora faltan los productos.
Toma una esfera negra que representa al carbono con sus dos oxígenos ¿Sabes cuántas moléculas de dióxido de carbono tienes que realizar? Son tres moléculas.
Entonces realiza el siguiente y último modelo.
Toma una esfera que representa al oxígeno y dos que serán los hidrógenos.
Si observas la ecuación, te puedes dar cuenta que necesitas cuatro moléculas de agua.
Con un análisis similar completa la siguiente tabla:

Con esta tabla y el modelo tridimensional te puedes dar cuenta que para que se cumpla la Ley de la Conservación de la Materia en los reactivos, la cantidad de cada elemento debe ser igual a la que hay en los productos.
Responde ahora las siguientes preguntas:
¿Qué cambió? Cambiaron las sustancias, pues se formaron otras.
¿Qué permanece constante? La cantidad de masa, o, dicho de otra manera, son los mismos elementos, pero reacomodados.
Realiza otra actividad química.
¿Qué necesitas?
- Nitrato de plomo
- Yoduro de potasio
- Tubo de ensayo
- Espátula
¿Cómo lo haces?
Agregas al nitrato de plomo el yoduro de potasio y observa.
Cuando el nitrato de plomo reacciona con el yoduro de potasio se observa la formación de un precipitado de color amarillo; a esta reacción se le conoce como “lluvia de oro”. La reacción química que tiene lugar es la siguiente:
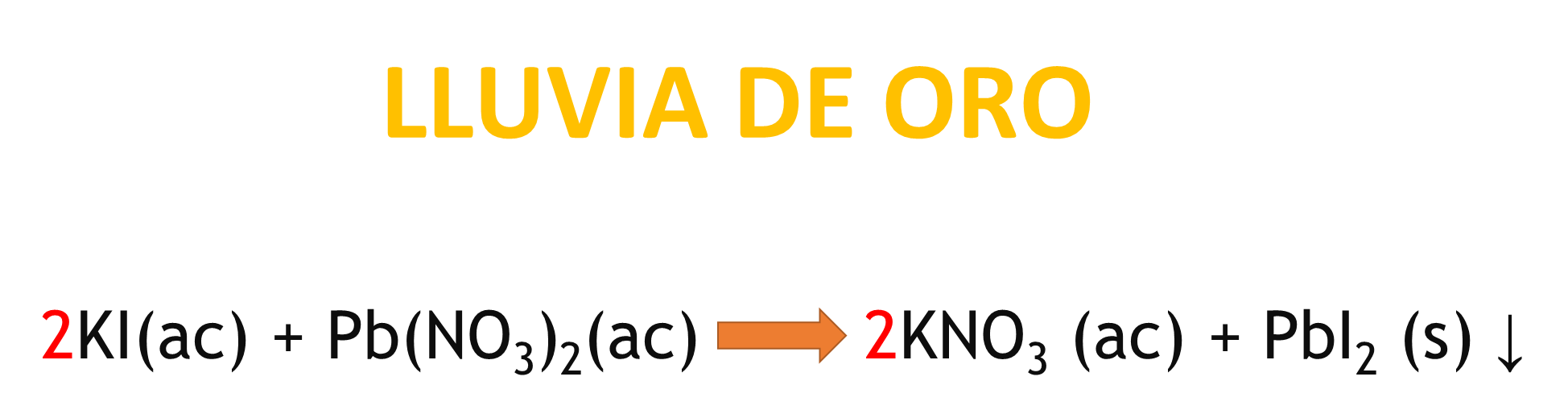
Analiza si esta reacción cumple con la Ley de la Conservación de la Materia:

Del lado de los reactivos tienes 2 átomos de potasio y 2 átomos en los productos, 2 átomos de yodo en reactivos y 2 en los productos, 1 átomo de plomo en reactivos y 1 en productos, 2 átomos de nitrógeno en reactivos y 2 átomos en productos, para el oxígeno tienes 6 átomos en reactivos y 6 en productos; por lo que puedes concluir que cumple con la Ley de Conservación de la Materia.
¿Qué cambió? Recuerda el cambio de color que se observa es debido a la formación de nuevas sustancias a partir de los reactivos que reaccionan.
¿Qué permanece constante? La cantidad de masa, o, dicho de otra manera, son los mismos elementos, pero reacomodados.
NOTA para el docente. Se te recomienda la página de la UNAM, donde podrás aprender y practicar de este tema.
http://objetos.unam.mx/quimica/reaccionQuimica/index.html
La representación de reacciones mediante las ecuaciones químicas ha sido para la ciencia una manera más sencilla de entender cómo se comportan y se transforman las sustancias.
Para saber cuántos átomos hay en reactivos y en productos es importante que observes que el coeficiente multiplica a cada símbolo del elemento tengan o no subíndices, habiendo logrado así, conocer la cantidad total de átomos.
Los subíndices indican la cantidad de átomos que componen una sustancia.
El trabajo de Lavoisier permitió que la ciencia mejorara sus mecanismos de investigación y de comprensión de los fenómenos naturales.
Realiza la última actividad llamada “huevo desnudo”.
¿Qué necesitas?
- Un huevo de gallina.
- Vinagre.
- Un frasco.
¿Cómo lo harás?
Agrega vinagre al frasco y pídele ayuda a un adulto.
Coloca suavemente el huevo en el frasco con vinagre cuidando que no se rompa. Ahora debes esperar a ver qué pasa. Anota en tu cuaderno los cambios que observes, por más pequeños que sean.
Después de aproximadamente 2 días, saca suavemente el huevo del vinagre y enjuaga ¿Qué tienes? ¡Un huevo sin cáscara!

¿Qué sucedió? La cáscara de un huevo está compuesta principalmente de carbonato de calcio, un mineral. Al sumergirse el huevo en el vinagre que contiene 4% de ácido acético, comienza una reacción química que disuelve la cáscara de carbonato de calcio.
El ácido acético reacciona con el carbonato de calcio y libera gas de dióxido de carbono, que es el que se observa como burbujas en la cáscara. El interior del huevo permanece intacto y se mantiene unido por las dos membranas frágiles justo dentro de la cáscara.
Realiza los cálculos pertinentes para comprobar la Ley de la Conservación de la Materia en esta reacción apoyándose de la ecuación química.
También responde las siguientes preguntas:
¿Qué cambio?
¿Qué permanece constante?
Hay quien afirma que la base del alma o la conciencia del yo es una simple reacción química en el cerebro.
El reto de hoy:
Busca el libro de la biblioteca digital del ILCE: De la alquimia a la Química. Autor: María Teresa de la Selva.
En este libro la autora conduce a los momentos más significativos que marcaron la historia de lo que llegaría a ser la química, y muestra a las principales figuras que, con sus aportaciones, determinaron el rumbo de su desarrollo.
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen3/ciencia3/118/htm/alquimia.htm
Atrévete a ver la química con otro sentido y comparte tu sentir en un pensamiento que puedas expresar en un breve texto.
Sin duda la química es una ciencia importante para el avance científico y la innovación; gracias a ella se conoce la estructura de los átomos, la tabla periódica de los elementos y cómo reaccionan éstos para dar lugar a distintos compuestos, los procesos químicos del ser humano, entre otros.
¡Buen trabajo!
Gracias por tu esfuerzo.
*Este material es elaborado por la Secretaría de Educación Pública y actualizado por la Subsecretaría de Educación Básica, a través de la Estrategia Aprende en Casa.