¿Cuáles son las relaciones entre reactivos y productos?
¿Cuáles son las relaciones entre reactivos y productos?
Aprendizaje esperado: verifica la correcta expresión de ecuaciones químicas sencillas con base en la ley de conservación de la materia.
Énfasis: explicar las relaciones proporcionales entre reactivos y productos con base en la ley de conservación de la materia.
¿Qué vamos a aprender?
¿Cuáles son las relaciones entre reactivos y productos?
Lee la siguiente frase célebre: de John C. Polanyi:
“La ciencia es una empresa que sólo puede florecer si se pone la verdad por delante de la nacionalidad, la etnia, la clase y el color”.
El propósito de esta sesión es explicarte las relaciones que existen entre reactivos y productos en una reacción química, con base en la Ley de conservación de la materia, mediante la experimentación y el uso de modelos. Te sugerimos conocer otro aspecto muy importante del lenguaje de la Química.
¿Sabías qué? Dentro de las células de tu cuerpo se llevan a cabo miles de reacciones de manera simultánea. Muchas de estas reacciones son incompatibles entre sí ya que, por ejemplo, mientras unas degradan moléculas otras las forman.
Para permitir que estas reacciones sucedan al mismo tiempo dentro de la célula, se ha desarrollado un sistema de compartimentos, que confina unas reacciones a algunas regiones de la célula y otras a diferentes regiones. Como ejemplo de compartimentos está la mitocondria y otros orgánulos.
Lo anterior es sumamente importante porque contribuye para que la célula lleve a cabo sus funciones de manera correcta y que los órganos y sistemas del cuerpo funcionen.
Una vez más ¡todo es una cuestión de Química. Los materiales que requieres son regla o escuadra, tabla periódica y masa moldeable o plastilina
¿Qué hacemos?
Las reacciones químicas se representan mediante símbolos y fórmulas que se expresan en una ecuación específica, sin embargo, no has atendido las cantidades que intervienen en ellas ¿por qué es importante esto?
Para preparar un pay de limón no basta con mezclar los ingredientes, en la receta se especifican las cantidades. Te has preguntado ¿qué pasaría si los mezclas sin pesarlos o medirlos?
O ¿por qué es importante ingerir la “dosis” correcta en la toma de un medicamento?
En el primer caso no obtendrías un delicioso pay de limón o al no ingerir las cantidades adecuadas de un medicamento, no habría mejoría en tu salud.
Si alguna cantidad de una receta de cocina se alterara, el resultado no sería el mismo, o bien, se tendría que modificar toda la receta de manera proporcional, para que el producto conserve sus cualidades.
Reconocerás la cantidad de átomos que hay en una sustancia, puedes utilizar la tabla periódica para conocer los símbolos de los elementos. Identifica el subíndice, que te indica el número de átomos del elemento.
En el caso del ácido sulfúrico
H2SO4
H hidrógeno tiene un subíndice 2, quiere decir que tienes 2 átomos de hidrógeno. S azufre no tiene un número como subíndice esto quiere decir que sólo hay 1 átomo de este elemento.
El subíndice del O oxígeno es 4, esto quiere decir que hay 4 átomos del elemento.
En las fórmulas químicas, estos números y los símbolos son importantes para reconocer la sustancia.
Realiza el siguiente conteo de átomos por cada fórmula.
LiF un átomo de litio y un átomo de flúor.
CaBr2 un átomo de calcio y dos átomos de bromo.
Al2O3 dos átomos de aluminio y tres átomos de oxígeno.
K3P tres átomos de potasio y un átomo de fósforo.
Conociste la importancia de los trabajos de Lavoisier, el desarrollo de la experimentación y la medición de las sustancias en sus experimentos, lo que le condujo a postular una de las leyes más importantes de la química, La ley de la conservación de la materia ¿lo recuerdas?
Otra aportación de Lavoisier a la química fue organizar a sus colegas para crear una nomenclatura sistemática, que si bien es cierto se ha modificado a lo largo de los siglos, ha permitido mantener un lenguaje propio que en cualquier parte del mundo se expresa de la misma manera.
Pues bien, en el año 1800 John Dalton dedujo una teoría que apoya las conclusiones de Lavoisier:
El número de átomos de cada elemento que participa en una reacción química es el mismo en los reactivos y en los productos, aunque la organización de los enlaces que los unen sea distinta.
Las reacciones químicas son procesos en los que los átomos rompen sus enlaces químicos para formar otras uniones y producir compuestos. Con ello cambia la naturaleza de las sustancias que intervinieron.
En todas las reacciones químicas unas sustancias son llamadas Reactivos o Reactantes y las que se transforman se llaman Productos.
Al ser diferentes los reactivos de los productos, presentan propiedades distintas, algunas de estas diferencias se pueden percibir de manera sencilla en cambios de color, olor, densidad, viscosidad, entre otras.
Generalmente los reactivos se escriben a la izquierda y los productos a la derecha y los separa una flecha la cual indica que ocurrió una transformación.
Observa la imagen
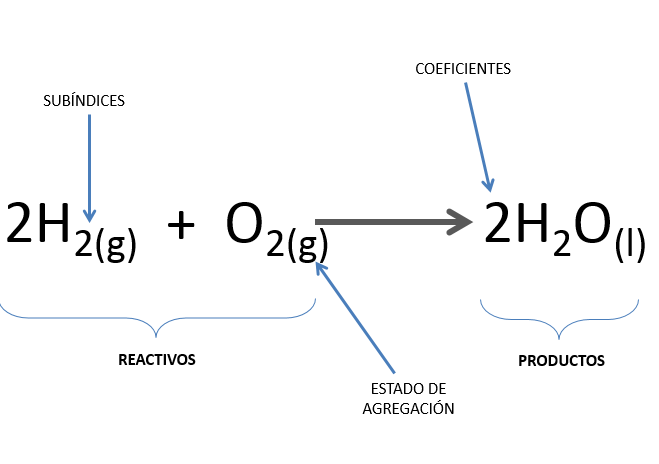
Reactivos Productos
Cuando intervienen o se producen dos o más sustancias se utiliza el símbolo “más”
Reactivo + Reactivo producto
Reactivo producto + producto
Puedes representar las fórmulas químicas con modelos, observa las moléculas que construiste con la masa moldeable, puedes identificar los átomos de cada una de ellas.
En una reacción química también encontrarás los estados de agregación de las sustancias, los cuales se colocan entre paréntesis como subíndices
(s) sólido
(l) líquido
(g) gas
(ac) acuoso
Si las sustancias que se obtienen en los productos son sólidos, se coloca una flecha indicando hacia abajo al lado de la sustancia y si se obtiene un gas la flecha que se dibuja va hacia arriba.
Observa los ejemplos
2Zn (s) + 2HCl (ac) 2ZnCl + H2
En una ecuación química observarás un número del lado izquierdo de las sustancias, aunque no siempre se escribe, a este número le llamamos coeficiente, éste número NO cambia la sustancia, pero si la cantidad de ella, es decir cuántas moléculas de esa sustancia reaccionan o se obtienen en una reacción química.
Por ejemplo
2 H2 + O2 2H2O
Ahora que ya conoces los datos que integran a una ecuación química, realiza la siguiente actividad.
En tu libreta escribe las partes de una ecuación química:
Subíndice
Coeficiente
Reactivos
Productos
Estado de agregación
Flecha de reacción
CH4 (g) + 2O2(g) CO2(g) + 2H2O (g)
Toma nota de los aspectos que te parezcan más interesantes, para compartirlos con tus compañeros o con tus profesores.
¿Observaste que el número de átomos se mantiene antes de la reacción y después de la reacción?
La ley de la conservación de la materia dice que la materia no se crea ni se destruye, solo se transforma, es decir que la cantidad de sustancia que participa en una reacción química es la misma que obtendrás al finalizar ésta, lo único que varía es que los átomos están dispuestos y unidos de otra manera formando sustancias nuevas ¿recuerdas la actividad experimental del bicarbonato de sodio NaHCO3 con vinagre que realizaste?
En esa sesión se te mostró como los reactivos y los productos tenían la misma masa al llevarse a cabo la reacción, comprueba con una actividad experimental esta Ley.
Necesitas una bolsa con cierre hermético, cloruro de calcio, bicarbonato de sodio, agua, y una balanza ya sea granataria o digital.
Toma las medidas de las masas.
Adentro de la bolsa tienes 4.2 g de bicarbonato de sodio y 5.55 g de cloruro de calcio, mezcla bien y agrega 50 mL de agua y cierra la bolsa, observa las burbujas y el desprendimiento de un gas el cual infla la bolsa.
¿Recuerdas cómo se llama esta reacción? Efervescencia
Si observas la balanza, ésta marca la misma cantidad de masa ¿qué piensas? Se cumple la Ley de la materia postulada por Lavoisier, ya que la cantidad de reactivos es la misma a la cantidad de productos.
Observa la imagen
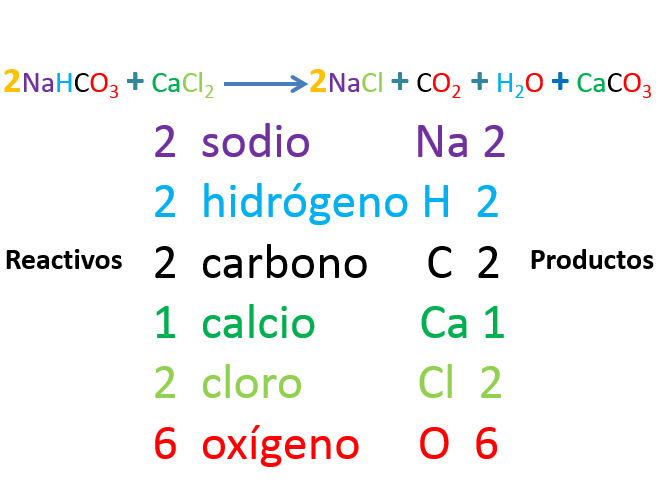
Cuenta los átomos antes y después de la reacción.
Comienza con el sodio, Na, observa 2 átomos del lado de los reactivos y 2 átomos de lado de los productos.
Para el hidrógeno, H, observa 2 átomos en los reactivos y 2 átomos del lado de los productos.
El carbono C tiene 2 átomos en los reactivos y 2 en los productos.
El calcio Ca 1 átomo en los reactivos y 1 átomo en los productos.
El cloro Cl, 2 átomos tanto en reactivos como en productos.
Por último y no menos importante el oxígeno O que tiene 6 átomos en los reactivos y 6 en los productos.
Como puedes observar, en la ecuación química también se cumple la Ley de la conservación de la materia.
DATO CURIOSO
La bolsa está hecha de una tela de nylon muy delgada, la cual está doblada dentro del volante, un interruptor mecánico es activado cuando hay un cambio en la masa que genera un impulso eléctrico, el cual les dice a los sensores que un choque ha ocurrido.
Las bolsas de aire generalmente contienen azida de sodio NaN3, que es un sólido blanco. Cuando se calienta, la azida sódica reacciona con rapidez y produce un gran volumen de gas de moléculas de nitrógeno N2: alrededor de 67 litros de gas por 130 gramos de azida de sodio.
La producción de nitrógeno rápidamente infla la bolsa, y el proceso completo dura alrededor de 40 milisegundos, y la bolsa se infla a una velocidad de 240 kilómetros por hora. Sin embargo, la reacción genera productos químicos tóxicos, y una serie de reacciones adicionales se requieren para reducir la posibilidad de lesiones a los pasajeros del coche.
La sustancia polvosa que sale de la bolsa de aire, es regularmente talco, el cual es usado por los fabricantes automotrices para mantener las bolsas flexibles y lubricadas mientras están guardadas.
Observa con mucha atención el siguiente video del minuto 1:47 – 2:35, que te permitirá recordar que sucede cuando se forman nuevos compuestos.
- ¿Modelos de moléculas?
Ya recordaste que se necesita para la formación de nuevos compuestos, recuerda que estas aprendiendo sobre reacciones químicas.
Recuerda que una ecuación química es la representación de una reacción química, la reacción es el fenómeno y la ecuación el lenguaje de la química.
A las sustancias que inician una reacción química se les llama reactivos y a las que se forman al llevarse a cabo la reacción, productos.
Para que una ecuación química esté bien escrita debe cumplir con los siguientes requisitos:
- Que las fórmulas de los reactivos y productos estén correctamente escritas.
- Debes indicar el estado de agregación de las sustancias participantes.
- Debes indicar el sentido de la reacción.
- Debes cumplir con la ley de la conservación de la materia.
Para que entiendas la representación de modelos compruébalo con una actividad experimental.
Para ello vas a utilizar la masa moldeable, y al final harás reaccionar un trozo de cinta de magnesio con el oxígeno, para esto acelerarás la reacción con la ayuda de la lámpara de alcohol.
Realiza la representación con modelos.
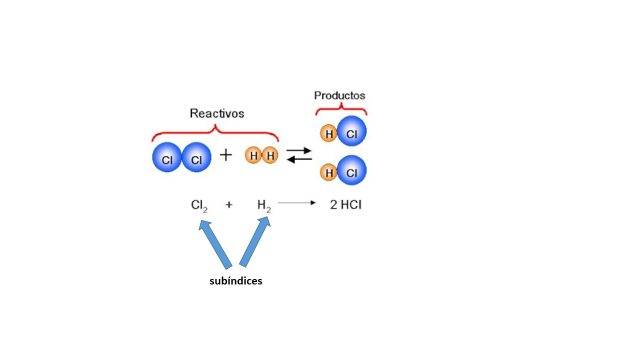
Ahora identifica el estado de agregación de las sustancias involucradas y las propiedades del producto formado.
Escribe la ecuación química con lo que sabes:
Mg(s) + O2 (g) → MgO
Como puedes observar, hacen falta átomos de oxígeno del lado de productos ¿qué puedes hacer para igualarlos?
Colocar 2 moléculas de MgO del lado de productos y ahora ajustar el número de átomos de magnesio del lado de reactivos.
Cuenta átomos para comprobar
ReactivosProductos
Átomos de magnesio 2Átomos de magnesio 2
Átomos de oxígeno 2Átomos de oxígeno 2
Observa cómo quedaría escrita correctamente la ecuación química una vez que cumple la ley de la conservación de la materia.
2 Mg(s) + O2 (g) → 2 MgO (s)
Los números que acabas de colocar indica el número de átomos involucrados en la reacción y se conocen, en el lenguaje de la química, como coeficientes estequiométricos.
La ecuación ahora se lee:
2 átomos de magnesio reaccionan con una molécula de oxígeno, para formar 2 moléculas de óxido de magnesio.
Has ajustado tu primera ecuación química.
Realiza una actividad experimental más.
Al + HCl
Representa en modelos a las sustancias involucradas, como lo hiciste en el caso anterior.
Estas sustancias, cuando reaccionan forman hidrógeno y cloruro de zinc.
Debes recordar que el hidrógeno es una molécula covalente y diatómica. La ecuación de esta reacción queda así:
HCl(ac) + Al(s) → AlCl3(ac) + H2(g)
Revisa la ecuación para determinar si tiene el mismo número de elementos en ambos lados. Como puedes darte cuenta, te hace falta átomos de hidrógeno y átomos de cloro en reactivos, así que realiza los ajustes con los modelos.
Ahora tienes 6 moléculas de ácido clorhídrico HCl, 2 átomos de aluminio en reactivos, mientras que, en productos, 2 de cloruro de aluminio y 3 moléculas de hidrógeno.
Cuenta los átomos para comprobar:
ReactivosProductos
Átomos de aluminio 2Átomos de aluminio 2
Átomos de hidrógeno 6Átomos de hidrógeno 6
Átomos de cloro 6Átomos de cloro 6
Observa cómo queda escrita correctamente la ecuación química una vez que cumple la ley de la conservación de la materia.
2Al(s) + 6HCl (l) → 3H2(g) + 2AlCl3(ac)
Coloca trozos de Aluminio en un tubo de ensayo y le agregas 5 ml de ácido clorhídrico, observa lo que sucede.
Como puedes observar, el Al metálico reacciona con el ácido clorhídrico líquido para formar moléculas de hidrógeno gaseoso, que se desprende y cloruro de aluminio que queda en disolución acuosa.
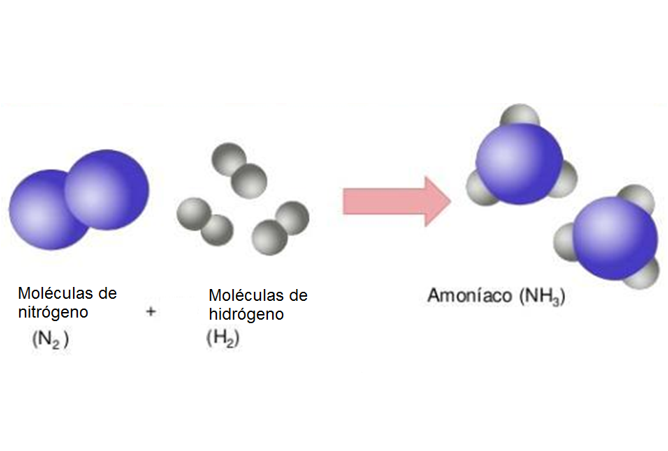
En el caso de la formación del amoniaco, compuesto químico utilizado en la producción de fertilizantes.
Formación del amoniaco.
Una actividad más, resuelve las siguientes ecuaciones químicas dibujando modelos o haciéndolos con la masa moldeable y posteriormente coloca la ecuación química agregando los coeficientes.
Recuerda que los coeficientes son los números al lado izquierdo de la sustancia):
Fe + S FeS
H2SO3 H2O + SO2
Cl + Na NaCl
Es importante comentarte que, aunque en el balanceo de las ecuaciones estas considerando el número de átomos representados por las fórmulas químicas, en realidad al hacer reaccionar las sustancias no participan solamente un átomo o dos, sino miles de millones de ellos.
Observa el siguiente video del minuto 9:25 a 11:20.
- Dígalo con química
Las ecuaciones químicas te ayudan a saber qué sustancias reaccionan y que nuevas sustancias se forman, puedes ver el estado de agregación y además cumple con la Ley de la conservación de la materia al colocar los coeficientes, revisando que se conserve la materia.
Realiza el último experimento y podrás observar la relación 2:1 del hidrógeno con el oxígeno, necesitarás tubos de ensayo, una pila cuadrada, agua, un vaso de precipitados y sal.
Observan cómo la química tiene su propio lenguaje, que facilita su comprensión ya que utilizas su simbología.
Caminar, correr, nadar y practicar deportes en forma individual o en equipo son solo algunas de las opciones de ejercicios que se pueden realizar. En muchos casos, encuentras ropa y equipos deportivos específicos para estas actividades. Las telas y los materiales innovadores, que los avances de la química textil hacen posible, puedes ayudar a mejorar el desempeño deportivo de atletas profesionales y de la población en general.
Los químicos textiles han realizado otras innovaciones que dan lugar a productos que tienen propiedades novedosas para el deporte.
Estas incluyen poliuretano, plásticos especiales, polímeros termoestables, policarbonato, y nanotecnología, solo por nombrar algunos.
El policarbonato, un plástico resistente a los golpes, se encuentra en los equipos deportivos de protección.
El policarbonato que se usa en los lentes de sol y en los visores de protección ayuda a proporcionar claridad óptica y resistencia a los golpes.
También se pueden encontrar lentes de policarbonato en las gafas de natación.
El poliuretano se encuentra con frecuencia en el calzado deportivo, confiriendo resistencia a los mismos. El poliuretano termoplástico pre-expandido es una espuma de partículas de célula cerrada, estas pequeñas “cápsulas” son muy elásticas y resistentes tanto al frío como al calor, además el material en sí es muy ligero y elástico.
Pero quizás la propiedad más destacada es su gran capacidad para retornar la energía, estas cápsulas guardan la energía que se genera en la amortiguación al apoyar el pie en el suelo y lo liberan en el momento del despegue.
El reto de hoy:
Revisa las siguientes ligas de la UNAM donde encontrarás información que puede apoyarte con el tema:
http://uapas2.bunam.unam.mx/ciencias/ecuacion_quimica/
En esta liga encontraras un documento de Balanceo de ecuaciones químicas.
www.unamenlinea.unam.mx/recurso/83342-balanceo-de-ecuaciones-quimicas
Es muy interesante que explores éstas ligas porque vienen animaciones y a partir de lo que tú sabes te pueden explicar más a fondo.
Cualquier persona con y sin discapacidades o dificultades pueden aprender juntos y pueden acercarse a la ciencia ya que no existen limitaciones para aprender algo nuevo, solo necesitas deseos de aprender.
La ciencia es tan noble que cuando la buscas, la puedes encontrar, es parecida a un libro que te está esperando paciente para tomarlo y aprender de él.
¡Buen trabajo!
Gracias por tu esfuerzo.
Para saber más:
Lecturas