¿Cómo explicar lo ocurre en una reacción química?
¿Cómo explicar lo ocurre en una reacción química?
Aprendizaje esperado: identifica las propiedades de los reactivos y los productos en una reacción química.
Énfasis: distinguir propiedades de reactivos y productos con la intención de explicar que en las reacciones químicas se forman nuevas sustancias.
¿Qué vamos a aprender?
Reflexiona sobre la frase de Rosalind Franklin, química y cristalógrafa británica. Sin duda, una gran mujer en la ciencia.
“La ciencia y la vida cotidiana no pueden y no deben estar separadas”
Disfruta de la ciencia como parte de tu vida cotidiana.
Recuerda tomar nota de todo aquello que consideres relevante e identifica los conceptos clave que te ayudarán a ir concretando tu aprendizaje.
Asimismo, actualiza tu quimi-glosario.
NOTA para el docente. Revisa la siguiente herramienta digital llamada nube de tags, también conocida como nube de etiquetas o nube de palabras. Es la representación gráfica de las palabras más usadas en un texto, una lección o un tema en donde se enfatizan las palabras clave. Este tipo de herramientas permiten al alumno afianzar el aprendizaje.
Consiste en identificar las palabras clave del tema, que se introducen en el documento que se genera visitando la página electrónica:
https://www.nubedepalabras.es/
Ahí encontrarás un asistente que te guiará paso a paso en la configuración de la imagen. Se puede elegir el color, las formas y el tamaño, así como exportar el archivo para utilizarlo en cualquier momento.
Los materiales que utilizarás en esta sesión son tu cuaderno, tu libro de texto de Ciencias con énfasis en Química, bolígrafos y colores.
¿Qué hacemos?
Muchos de los cambios que observas en el mundo que te rodea se deben a reacciones químicas. Por ejemplo, el cambio de color en las hojas de los árboles o el crecimiento de una flor.
Las reacciones químicas satisfacen muchas de las necesidades humanas, además de estar presentes en el organismo durante procesos como la digestión y la respiración, por mencionar algunos.
Una reacción química es un proceso en el que una o más sustancias se transforman en sustancias diferentes de las iniciales, cambiando así, tanto su composición como sus propiedades.
Un ejemplo de reacción química es la combustión del papel, donde el fuego del encendedor provee de energía al papel para iniciar la reacción. Durante ésta, hay desprendimiento de energía en forma de luz y calor.
Además, puedes observar que el papel cambió su composición y propiedades, ya que después de la combustión se ha reducido a cenizas, de color, textura y forma diferentes a la hoja original.
¿Sabías qué? Los monos capuchinos de América del Sur son capaces de usar repelentes naturales contra los mosquitos.
Encuentran ciempiés en la corteza de los árboles, que segregan sustancias químicas protectoras (benzoquinonas, alcaloides, fenoles, terpenoides y ácido cianhídrico) y se frotan la piel con ellos.
En los cambios químicos se produce la transformación de sustancias en otras diferentes y, por lo tanto, las primeras pierden sus propiedades originales.
El cambio químico es el principal objeto de estudio de la química, por lo que es necesario para los químicos tener un lenguaje en común para representarlo y, de esa manera, entenderse y comunicarse independientemente del idioma que hablen.
Con este fin, se estableció lo que se conoce como ecuación química.
Una ecuación química es la representación simbólica de una reacción química. Muestra las sustancias que intervienen en la reacción antes y después de efectuarse, así como la proporción en la que participan en la reacción.
Una manera muy sencilla de representar una ecuación química es la siguiente:
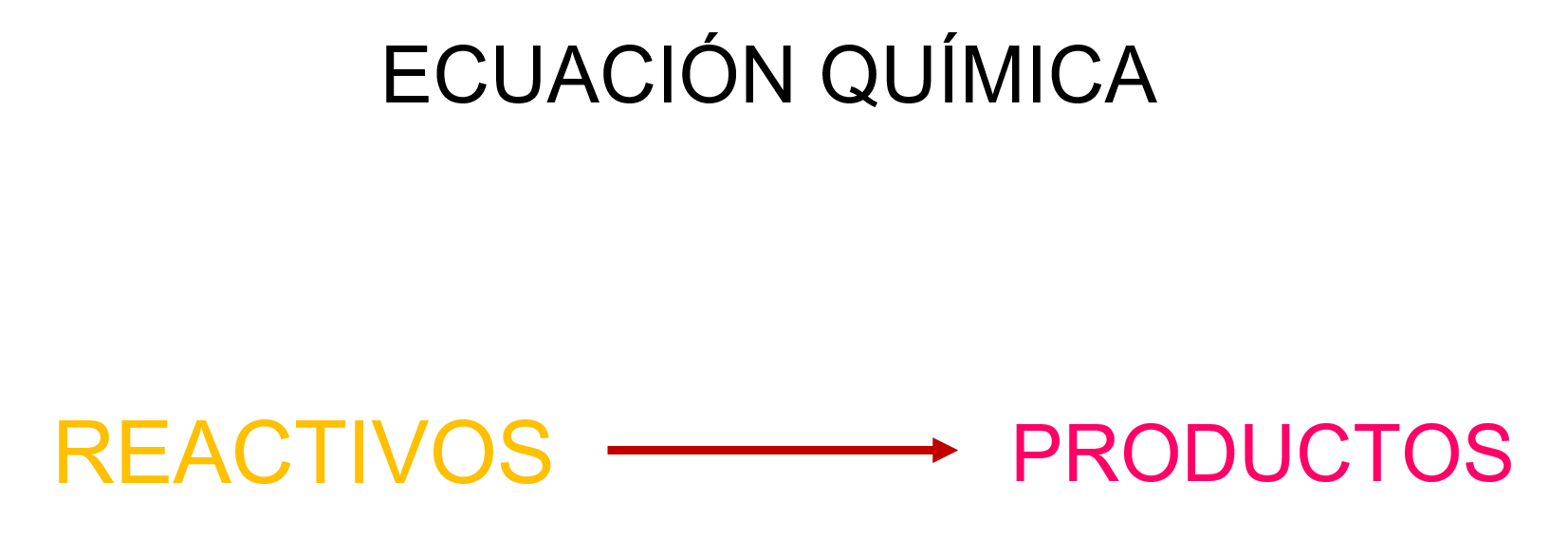
Sin embargo, como casi siempre se tienen dos o más reactivos, y dos o más productos, lo mejor es escribir la ecuación química que represente la cantidad de reactivos y productos que interactúan en la reacción química.
El signo +, en los reactivos, significa “reacciona con” y la flecha, “se produce o se forma”.
Si hay más de un producto, también se usa el signo + para señalar cada uno de los productos formados.
A las sustancias que reaccionan y producen un cambio químico se les denomina REACTIVOS. Se escriben del lado izquierdo de la ecuación y son las sustancias que hay antes de producirse la reacción química.
A las sustancias que se generan después de efectuarse un cambio químico se les conoce como PRODUCTOS.
Los reactivos y productos de una reacción química pueden encontrarse en diferente estado de agregación o estado físico. Éstos se indican delante del símbolo o fórmula química de la sustancia y entre paréntesis.
- Sustancias sólidas (s)
- Sustancias líquidas (l)
- Sustancias gaseosas (g)
- Sustancias disueltas en agua (ac)
También existen flechas hacia arriba o hacia abajo: Hacia arriba indican el desprendimiento de un gas, hacia abajo, indican un sólido que precipita. Cuando se usan flechas se omiten las letras entre paréntesis, por ejemplo, cuando se desprende un gas se puede indicar como (g) o solo con la flecha apuntando hacia arriba, delante del símbolo o fórmula química.
Las propiedades de reactivos y productos dependen de varios aspectos, entre ellos:
El número y átomos de los elementos que forman la sustancia, los enlaces que los unen, la disposición espacial de los átomos y la interacción que se presenta entre las moléculas vecinas.
¿Qué ocurre a nivel submicroscópico? ¿Por qué ocurren los cambios químicos? ¿Por qué unas sustancias se transforman en otras diferentes?
Se sabe que los átomos de los reactivos están unidos entre sí y forman sustancias químicas.
Cuando se produce una reacción química se rompen las uniones de los reactivos, lo que ocasiona que los átomos de los elementos que forman la sustancia se reordenen de manera diferente para formar nuevas sustancias o productos. Es decir, que una reacción o cambio químicos implica la ruptura y formación de enlaces.
La descripción detallada de todo el proceso, que a nivel atómico se produce durante una reacción química, se conoce con el nombre de mecanismo de reacción.
Por tanto, el mecanismo de una reacción no es más que explicar con el mayor detalle posible cómo se producen los cambios de los reactivos para llegar a los productos. Esto implica indicar la posición de los átomos y la ruptura y formación de los enlaces a lo largo del proceso de reacción.
Observemos la siguiente simulación de la reacción química entre el nitrato de plata (AgNO3) disuelto en agua y una laminilla de cobre en estado sólido.
- Video1.Q3_B3_PG2_F1_SEM37_020521-ANEXO3
(del min. 7.56 al 9.14)
Puedes observar que se lleva a cabo una reacción de sustitución simple, en la cual, los cationes de la plata (Ag+) y los aniones del nitrato (NO3–) se disocian en la disolución, así como los cationes de cobre (Cu2+). Éste último, pasa a formar junto con los aniones de nitrato (NO3–) una nueva sustancia conocida como nitrato de cobre II, Cu(NO3)2 disuelto en agua. En cambio, los átomos de plata (Ag) forman pequeños cristales que se precipitarán o quedarán adheridos a la lámina de cobre.
¿Pudiste apreciar cómo a nivel submicroscópico hubo un reacomodo de átomos de los reactivos?
Durante la reacción se generan nuevos enlaces para la formación de productos químicos muy diferentes a los reactivos.
Esto sucede en todas las reacciones químicas, por eso es por lo que las nuevas sustancias tienen propiedades físicas y químicas muy diferentes.
La energía que se absorbe o se desprende está directamente relacionada con el tipo y número de enlaces que se rompen, esto sucede por medio de colisiones con la suficiente energía entre los átomos, donde hay un reordenamiento, lo que origina la formación de otras sustancias.
En los reactivos se rompen los enlaces y los átomos ahora pueden organizarse de otra manera, formando nuevos enlaces para permitir la generación de productos. Por tanto, en una reacción química lo que ocurre, es que se rompen unos enlaces y se formen otros para dar lugar a los productos. Los átomos son los mismos pero las sustancias cambian, pues los átomos se agrupan de otra forma.
Experimenta: En esta ocasión las actividades experimentales serán demostrativas, es decir, sólo podrán ser realizados por sus profesoras o profesores, ya que los reactivos utilizados deben ser manejados con mucho cuidado para evitar accidentes.
¿Qué se necesita?
Los materiales que se utilizarán para la primera actividad experimental son:
- Dos cucharadas de hidróxido de sodio.
- Dos cucharadas de sulfato de hierro II.
- Dos vasos de precipitado de 250 ml
- Varillas de vidrio o agitadores.
- Agua.
¿Cómo se hace?
- Prepararán dos disoluciones: Toma un vaso de precipitado y agregas 150 mililitros de agua y dos cucharadas de hidróxido de sodio. Agitas suavemente.
- En el segundo vaso la disolución será de 150 mililitros de agua con dos cucharadas de sulfato de hierro (II).
- Procede a añadir la disolución de hidróxido de sodio en la de sulfato de hierro (II).
Observa detenidamente lo que sucede y regístralo en tu cuaderno.
Se ha manifestado un cambio de color y se ha formado un precipitado hidróxido de hierro (II) una vez que el sulfato de hierro (II) interaccionó con el hidróxido de sodio.
Identifica los reactivos y productos.
En esta reacción los reactivos son el sulfato de hierro (II), que interacciona con hidróxido de sodio, ambos en disolución acuosa.
Los productos de la reacción son hidróxido de hierro, que precipita y sulfato de sodio en disolución acuosa.
Registra en tu cuaderno todos los cambios que has observado durante estas reacciones químicas y comparte tus resultados con tus compañeras y compañeros.
¿Qué se necesita para realizar la siguiente actividad experimental?
- Cinta de magnesio.
- Lámpara de alcohol.
- Cerillos.
- Pinzas de disección.
¿Cómo se hace?
Con las pinzas de disección se toma la cinta de magnesio, que se enciende con la ayuda de la lámpara de alcohol. Registra sus observaciones.
Se llevó a cabo una reacción de combustión. El magnesio reacciona con el oxígeno que se encuentra en el aire y la reacción se manifiesta con luz y calor.
Durante la combustión, las temperaturas pueden ser tan altas que provocan que el óxido de magnesio se caliente a un punto de brillo blanco.
La flama es tan brillante que objetos bañados en luz arrojan profundas sombras, inclusive cuando están en la luz solar.
¿Cuáles son ahora los reactivos y los productos?
En esta reacción de combustión los reactivos son el magnesio en estado sólido que interacciona químicamente con oxígeno en estado gaseoso.
El producto de la reacción es óxido de magnesio en estado sólido.
Algunos cambios químicos no son perceptibles porque ocurren con mucha lentitud, pero hay otras reacciones que suceden rápidamente y el cambio se puede apreciar a simple vista porque se manifiesta de manera evidente; como en la combustión de la cinta de magnesio, en la cual hay una manifestación de luz y calor.
Otro ejemplo común es la efervescencia que producen ciertas reacciones al liberar un gas, como el caso de los antiácidos en pastillas. Otros son la formación de un precipitado, es decir, que la sustancia que se forma no se disuelve.
Es conveniente aclarar que no siempre que se produce una reacción hay cambio de color, ya que hay casos en los que reactivos y productos pueden tener colores iguales.
Dentro del organismo existen sustancias químicas denominadas enzimas digestivas. Estas son proteínas de estructura compleja que actúan durante la digestión, produciendo cambios químicos importantes en los alimentos que ingieres.
Las enzimas digestivas se clasifican en tres tipos: Las proteasas, que se encargan de digerir las proteínas; las lipasas, que digieren las grasas; y las amilasas, que digieren los carbohidratos.
Las enzimas degradan los alimentos a sus componentes más simples: Las proteínas hasta aminoácidos, los lípidos hasta ácidos grasos y glicerol, y los carbohidratos o glúcidos hasta monosacáridos; de ellos, la glucosa es la de mayor importancia, ya que, gracias a ella, los alimentos que consumes son convertidos en la energía que utilizas en actividades tan sencillas como estudiar, jugar, trabajar, caminar y hacer actividad física.
A las enzimas se les conoce como biocatalizadores, además de disminuir la cantidad de energía requerida, aseguran que las reacciones químicas se den en el lugar y momento adecuados, ya que controlan directamente cada uno de éstos.
Observa la siguiente simulación. Se ha realizado para la seguridad de todos, ya que se utilizan sustancias altamente tóxicas y corrosivas.
- Q3_B3_PG2_F1_SEM37_020521-ANEXO4
(del min. 16.51 al 17.44)
A este experimento se le conoce como la “mamba negra” como referencia a una serpiente que es muy peligrosa por su veneno, y una de sus características físicas es que la mayor parte de su cuerpo es negro.
Para este experimento se utiliza sacarosa (C12H22O11), o como comúnmente se le llama, azúcar de mesa. Recuerda algunas propiedades del azúcar: Se encuentra en estado sólido, los granos que la conforman son diminutos al ojo humano, su composición química es de oxígeno, carbono e hidrógeno y por lo regular la utilizas para endulzar algún alimento.
Se vierten un par de cucharadas de azúcar al vaso de precipitado, e inmediatamente se agrega ácido sulfúrico (H2SO4). Puedes apreciar que se encuentra en estado líquido, sin embargo, es en realidad una disolución acuosa; esta sustancia es altamente corrosiva y es utilizada en la elaboración de fertilizantes e incluso en la manufactura de detergentes y plásticos.
Al momento de agregar el ácido sulfúrico con el azúcar debes revolver bien las sustancias; al pasar unos segundos, los reactivos comienzan a transformarse. Lo primero que se puede apreciar es un cambio de color e inmediatamente un desprendimiento de gas -que en este caso es dióxido de carbono (CO2) y dióxido de azufre (SO2)- si observas el termómetro, hay un aumento en la temperatura, lo cual indica que es una reacción exotérmica; en pocas palabras hay una liberación de energía en forma de calor.
En la animación se observa cómo comienza a sobresalir una sustancia de color negro, el carbono (C), que gracias a la fuerza de los gases emanados por la reacción sale expulsado del vaso de precipitado. Una de sus principales propiedades es que se encuentra en estado sólido. Otro de los productos obtenidos es el agua (H2O) en estado líquido.
Revisa lo que indica la ecuación química de esta reacción. En reactivos tienes sacarosa en estado sólido, que reacciona con dos moléculas de ácido sulfúrico disuelto en agua y produce once moléculas de carbono en estado sólido, una molécula de dióxido de carbono en estado gaseoso, trece moléculas de agua en estado líquido y dos moléculas de dióxido de azufre en estado gaseoso. Estos productos son muy diferentes a las sustancias iniciales tanto física como químicamente, ya que el uso y las funciones de los productos son muy distintas a las de los reactivos.
¿Qué es lo que se puede destacar de esta simulación?
¿Observaste cambios considerados en las propiedades físicas y químicas de los reactivos y productos?
¿Piensas que las sustancias nuevas que obtuviste puedan regresar a su estado original?
Investiga ¿Cuáles son las fuentes principales del dióxido de carbono CO2 y del dióxido de azufre SO2?
Anota tus respuestas en tu libreta, compártelas con tus compañeros y plática con tu profesor para que les resuelva las dudas que llegues a tener.
¿Piensas que en tu casa pueden llevarse a cabo reacciones químicas en las que los reactivos tienen cambios tan evidentes como en las actividades experimentales que se realizaron en esta sesión? ¿Por qué?
Observa con atención cuando en casa encienden un cerillo, cuando disuelven una pastilla para la acidez estomacal, cuando fríen un huevo o incluso cuando digieren los alimentos. En tu libreta anota las propiedades de las sustancias que se pueden apreciar antes y después de llevarse a cabo la reacción química.
Puedes utilizar el siguiente cuadro comparativo para anotar las propiedades de los reactivos y productos que participan en las reacciones químicas que suceden comúnmente en casa o en su organismo.

El veneno de las serpientes o de cualquier tipo de animal ponzoñoso puede generar diferentes reacciones al entrar en contacto con el organismo. Los signos de envenenamiento pueden variar dependiendo de la cantidad de veneno trasmitido, periodo de evolución, zona afectada y si la víctima fue mordida o picada varias veces, así como el estado de salud del animal. Los síntomas más frecuentes en las mordeduras por serpientes son: Dolor, edemas progresivos, heridas por colmillos, equimosis, parestesias, náuseas y coagulación extravascular diseminada.
Las personas que han sido mordidas requieren de atención médica inmediata, el tratamiento incluye administración de fármacos para el control del veneno, que deben ser aplicados en dosis adecuadas, dependiendo el grado de envenenamiento y la especie animal.
En esta sesión recordaste que una reacción química se puede interpretar con símbolos, fórmulas y números a los cuales se les conoce como ecuación química.
Observas que las propiedades físicas de los reactivos también se pueden interpretar con apoyo de las ecuaciones químicas, los productos resultantes de diferentes reacciones químicas como el precipitado de hidróxido de hierro (II), la combustión de la cinta de magnesio o la deshidratación de la sacarosa presentan cambios muy notorios durante y después de llevarse a cabo la reacción química, lo cual es un indicativo perceptible para comprobar que hubo un cambio químico; aunque también hay reacciones químicas que no se presentan de manera tan evidente, como la degradación de los nutrimentos en la digestión o en el envenenamiento por mordedura de algún animal.
El reto de hoy:
Se te recomienda leer el libro “La ciencia asombrosa” de la editorial ideaka, donde encontrarás diferentes actividades experimentales en las que pueden observar las propiedades de los reactivos y productos, antes y durante la reacción química.
¡Buen trabajo!
Gracias por tu esfuerzo.
*Este material es elaborado por la Secretaría de Educación Pública y actualizado por la Subsecretaría de Educación Básica, a través de la Estrategia Aprende en Casa*.