¿Cómo asignamos el número de oxidación de elementos no metálicos representativos?
¿Cómo asignamos el número de oxidación de elementos no metálicos representativos?
Aprendizaje esperado: relaciona el número de oxidación de algunos elementos con su ubicación en la tabla periódica.
Énfasis: relacionar el número de oxidación de algunos elementos no metálicos representativos con su ubicación en la tabla periódica.
¿Qué vamos a aprender?
Es importante destacar el papel de los científicos e investigadores que han hecho aportes a las ciencias químicas.
Lee la siguiente frase célebre de Nikola Tesla, que fue un inventor, ingeniero y mecánico serbocroata, nacionalizado estadounidense.
“La historia de las ciencias nos demuestra que las teorías son perecederas. Con cada nueva verdad revelada, tenemos una mejor comprensión de la naturaleza y nuestras concepciones y nuestros puntos de vista se modifican”.
En esta sesión estudiarás los siguientes temas:
- La ubicación de los elementos representativos no metálicos en la tabla periódica.
- La asignación del número de oxidación de elementos no metálicos representativos.
Las reacciones de los no metales.
Los materiales que utilizarás es tu cuaderno, tu libro de texto, bolígrafo, lápiz, colores y tu tabla periódica.
¿Qué hacemos?
Revisa la siguiente página web, en ella se presentan simuladores virtuales con los que puedes construir átomos, realizar balanceo de ecuaciones químicas, identificar el pH de algunas sustancias, entre muchos temas más que te servirán para que tus clases sean más interactivas.
En casa tienes uno de los complementos más importantes de la gastronomía, la sal, que es utilizada normalmente para intensificar los sabores de los alimentos.
Existe un gran debate sobre la calidad de la misma, y es que la sal que comúnmente se utiliza en casa, mejor conocida como sal de mesa, tiene una competidora en el mercado; la sal marina.
La diferencia radica en dos factores. Su lugar de origen y su proceso de extracción.
La sal de mesa se extrae de minas terrestres, mientras que la sal marina se obtiene del mar.
Las instituciones de salud han sugerido a la población mundial disminuir el consumo de sal, ya que su uso desmedido puede ocasionar enfermedades como la hipertensión arterial. También hay quien dice que la sal marina es menos dañina que la sal de mesa, sin embargo, la ciencia demuestra que ambas están compuestas por sodio y cloro y su fórmula química es NaCl.
En sesiones anteriores has aprendido sobre la composición de la sal, pero te has preguntado: ¿qué sucede con los electrones cuando forman la sal o cloruro de sodio? ¿Comparten o transfieren sus electrones al formar este compuesto?
Ubícalos en la tabla periódica estos elementos; puedes observar que dicho compuesto está formado por un metal y un no metal.
Analiza e integra los conocimientos que hasta el momento has adquirido.
- ¿Qué es una reacción química?
- ¿Qué es un enlace?
- ¿Qué tipo de enlace forma el cloruro de sodio?
Responde estas preguntas en tu cuaderno y complementa la información.
- ¿Sabías que?
(del min. 4.38 al 5.07)
Muchas de las reacciones químicas que están presentes en nuestra vida diaria ocurren entre no metales.
Ubica en la tabla periódica los elementos.
Recuerda que están ordenados en 7 periodos y 18 grupos.
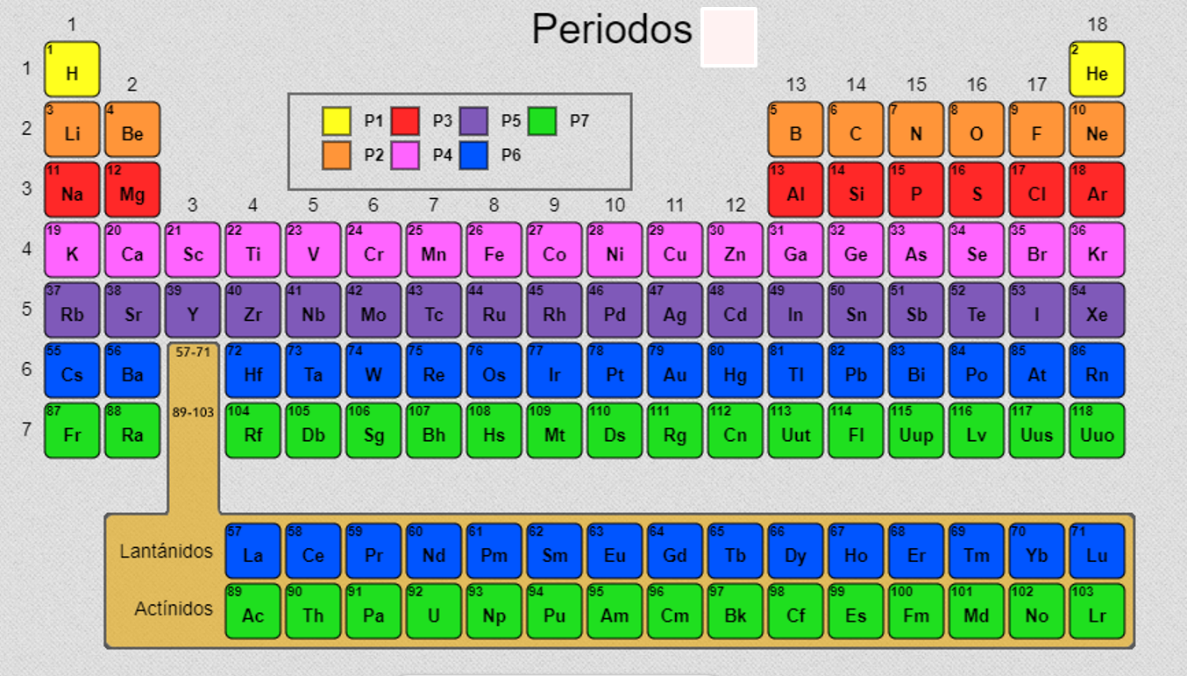
En el grupo 1 se encuentra el litio, que pertenece a los metales alcalinos, a excepción del hidrógeno, que es un no metal.
En el grupo 2 se encuentra el berilio, que pertenece a los metales alcalinotérreos.
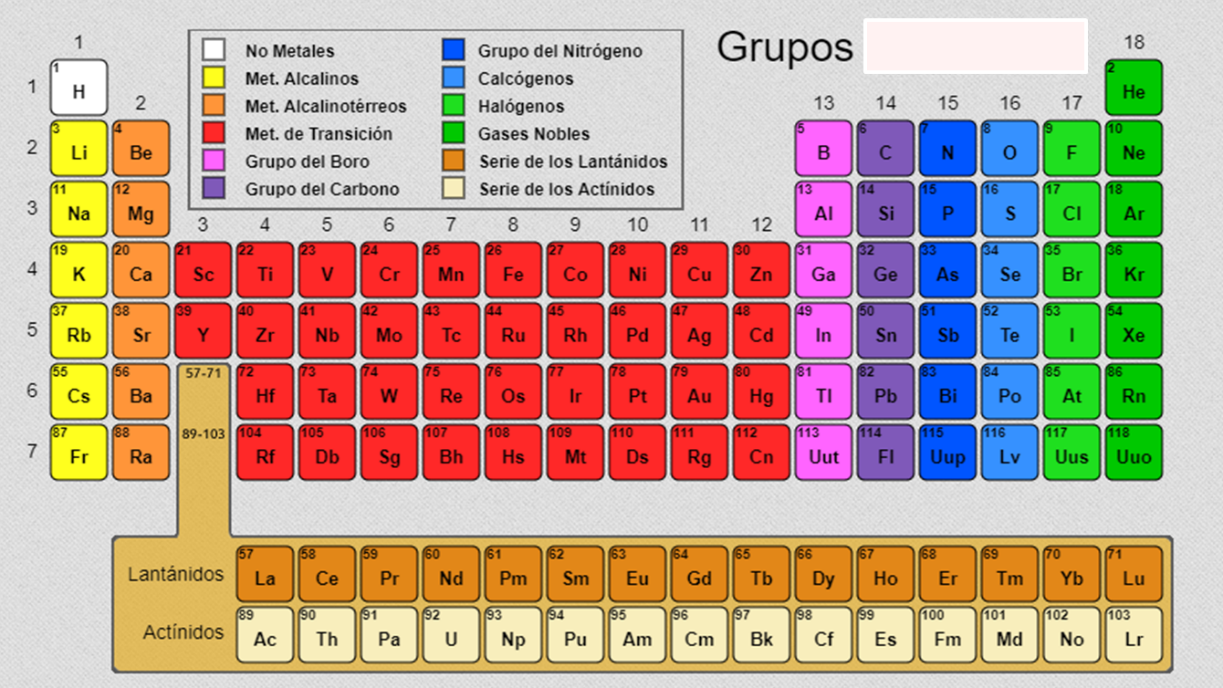
Al centro de la tabla periódica se encuentran los metales de transición, donde se incluyen los lantánidos y actínidos.
En el grupo 13 se encuentra el boro y el aluminio, el primero es un metaloide o semimetal y el segundo es un metal.
En los grupos 14, 15, 16, 17 y 18 encuentras a los no metales y también una franja quebrada que pertenece a los semimetales.
Para explicar el número de oxidación retomarás el modelo atómico de Niels Bohr, el cual propone que los electrones se distribuyen en órbitas o niveles energéticos.
Observa y analiza el siguiente ejemplo e imagina lo que sucederá.
Ahora tienes dos elementos que formarán un compuesto. Los electrones están representados por los bombones o las bolas de unicel.
Supón que en la órbita más externa se tienen que completar 8 electrones de valencia, con el propósito de que el compuesto sea químicamente estable.
- Ejemplo 1. ¿Qué resulta más fácil, perder o ganar electrones de valencia?
Perder 1 electrón de valencia.
Cuando un elemento pierde un electrón de valencia se convierte en un catión, es decir, que adquiere una carga positiva. - Ejemplo 2. ¿Qué resulta más fácil, perder o ganar electrones de valencia?
Ganar electrones de valencia.
Cuando un elemento gana un electrón de valencia se convierte en un anión, es decir, que adquiere una carga negativa.
Regresa al modelo de Niels Bohr y piensa en la sal cuya fórmula química es NaCl.
El sodio se localiza en el grupo 1, por lo que es un metal alcalino, su número atómico es 11; con base en el modelo de Bohr, tiene un electrón de valencia en la órbita más externa.
El cloro es un no metal, pertenece al grupo 17, es un halógeno, su número atómico es 17 y en su órbita más externa tiene 7 electrones de valencia.
Analiza las siguientes preguntas:
¿Qué resulta más fácil para el sodio, ganar 7 electrones de valencia o perder un electrón de valencia?
Perder un electrón de valencia. Por lo que se convierte en un catión.
¿Qué resulta más fácil para el cloro? Ganar un electrón de valencia, por lo que se convierte en un anión.
Al reaccionar el sodio y el cloro, para producir el cloruro de sodio (NaCl) se unen por medio de un enlace iónico.
A una reacción en la que un átomo pierde o gana electrones de valencia se le conoce como reacción de óxido-reducción o reacción redox.
Examina el ejemplo de la formación del cloruro de sodio. Durante la reacción se produce la oxidación de un átomo que pierde uno o más electrones de valencia. Cuando el átomo se oxida, es el agente reductor.
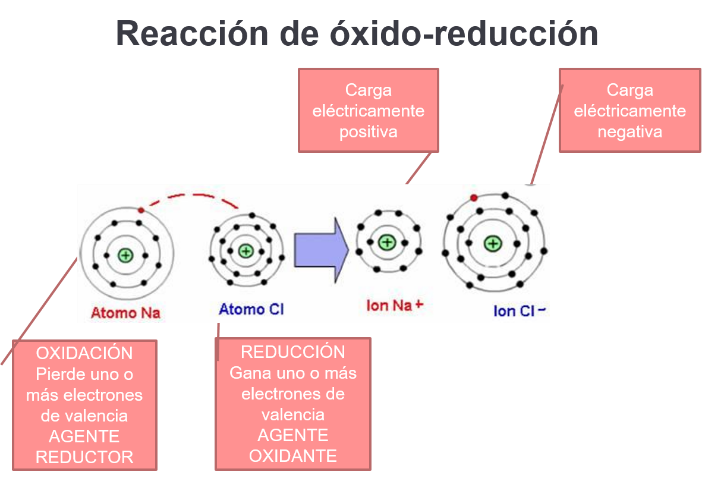
Otro átomo se reduce cuando gana uno o más electrones de valencia. Cuando el átomo se reduce, es el agente oxidante.
Recuerda la siguiente nemotecnia: SOPE, Siempre Oxidación es Pérdida de Electrones de valencia, por lo tanto, reducción es ganancia de electrones de valencia.
¿Cuál es la importancia de completar 8 electrones de valencia en la órbita más externa?
Esto sucede en los enlaces iónicos, donde los electrones son donados para que ambos átomos tengan 8 electrones en su última órbita para ser estables.
Recupera el siguiente concepto: el número de oxidación es un número entero que representa el número de electrones que un átomo cede, gana o comparte cuando forma un compuesto.
En la sesión anterior aprendiste sobre las reglas generales de la asignación del número de oxidación en los metales, las cuales se aplican también para los no metales.
Pon a prueba lo aprendido. Observa y escucha con atención el siguiente video.
- Q3_B4_PG1_F1_SEM28_240221_Anexo 4
(del min. 9.55 al 11.03)
Experimenta, retoma y analiza la siguiente actividad experimental.
¿Qué necesitas?
- Ácido clorhídrico
- Aluminio
- Un globo y un palito de madera o metal
- Q3_B4_PG1_V2_SEM28_230221_Anexo 5
https://youtu.be/pu08J_jORiE
(del min. 11.04 al 12.52) - Q3_B4_PG1_V2_SEM28_230221_Anexo 6
https://youtu.be/pu08J_jORiE
(del min. 12.53 al 17.12)
Lo que se observa es la oxidación y reducción de los materiales seguido de la liberación de gas hidrógeno molecular. El globo estaba lleno de este gas que es altamente inflamable, por esta razón, al acercarse al fuego, explotó.
Analiza la reacción de oxidación y reducción de esta actividad experimental.
Tienes aluminio que se encuentra en estado libre por lo que su número de oxidación tiene un valor de cero, después en el compuesto de ácido clorhídrico, el hidrógeno tiene un número de oxidación de +1 y el cloro de -1.
Producto de la reacción de óxido-reducción se obtiene cloruro de aluminio y gas de hidrógeno molecular que se ha liberado durante la reacción.
El aluminio pierde 3 electrones de valencia en cada átomo y queda con un número de oxidación de +3, por lo tanto, se oxida.
El hidrógeno gana 1 electrón de valencia por cada átomo y es liberado en forma de gas como hidrógeno molecular. Por esta razón, en la actividad experimental observaste que el globo se llenó de este gas y explotó al entrar en contacto con el fuego.
Anota tus observaciones en tu cuaderno y compártelas con tus compañeros. - Q3_B4_PG1_V2_SEM28_230221_Anexo 7
(del min. 19.25 al 20.01 )
Cada año, alrededor de 20% de la producción mundial de metal se pierde completamente a causa de la corrosión.
Los productos elaborados, como maquinaria y estructuras, son inutilizados debido a esto, en cuyo caso el precio del metal se incrementa por los costos de las medidas de protección, como el uso de materiales metálicos de mayor resistencia química y aplicación de recubrimientos. Esto genera mayores costos de acondicionamiento y embalaje durante el transporte, así como gastos adicionales a los trabajos de reparación y mantenimiento.
Si analizas la tabla periódica, podrás predecir el número de oxidación de los elementos representativos de acuerdo con su grupo. Observa la siguiente tabla periódica, en ella se presentan los números de oxidación de los elementos representativos, pongan especial atención en los no metales.
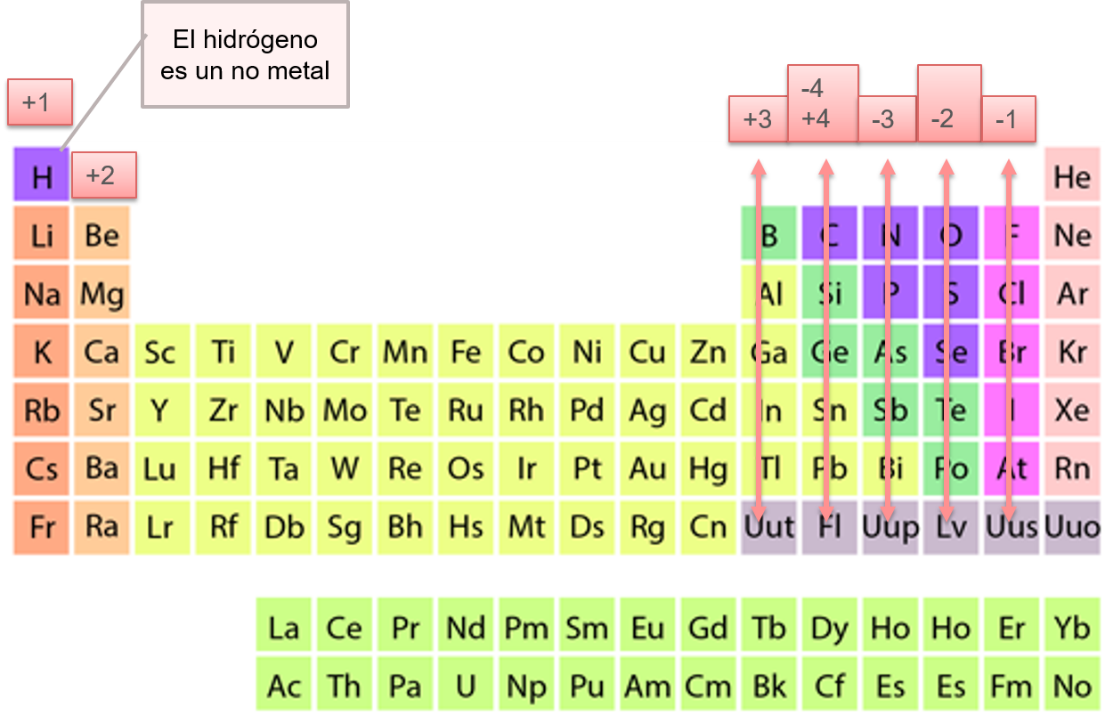
Recuerda que el hidrógeno es un no metal; es el primer elemento de la tabla periódica y pertenece al grupo 1, por lo que en su única órbita tiene 1 electrón de valencia, que tiende a perder, es por eso que su número de oxidación es +1.
Observa el grupo 13, el boro pertenece a este grupo, en su órbita más externa tiene 3 electrones de valencia que tiende a perder. Su número de oxidación es +3.
Observa ahora el grupo 17, donde se encuentra el flúor; en su órbita más externa tiene 7 electrones de valencia, por lo que tiende a atraer 1 electrón. Su número de oxidación es -1.
El número de oxidación permite predecir la reacción de oxidación y de reducción entre los elementos, así como su comportamiento en determinadas reacciones químicas.
Se te sugiere realizar un organizador gráfico, puede ser un mapa mental o cuadro sinóptico. Si te es posible, comparte los resultados de forma creativa y segura con tu maestra o maestro.
En esta sesión aprendiste a asignar los números de oxidación a los no metales. También que las reacciones de óxido-reducción se llevan a cabo en la vida diaria, en actividades experimentales y en la industria. Por medio de este tipo de reacciones se obtienen productos que utilizas de manera cotidiana.
Comprendiste a partir del modelo atómico de Niels Bohr la tendencia que tienen los átomos de perder, ganar o compartir sus electrones de valencia, de manera que sean químicamente estables.
Se predijo el número de oxidación con base en su ubicación en la tabla periódica y la formación de sus enlaces.
Analizaste a partir de una actividad experimental, cómo es que se oxidan o reducen los elementos químicos de un compuesto.
Recuerda que el número de oxidación se relaciona con el número de electrones de valencia en la órbita o nivel de energía más externo de un átomo, es decir, el número de oxidación se asigna de acuerdo con el grupo al que pertenecen los elementos químicos.
Cuando los átomos de los elementos se encuentran libres o formando moléculas como el oxígeno molecular, su número de oxidación es cero.
En un compuesto químico, la suma algebraica de los números de oxidación de los elementos que lo forman siempre da como resultado cero, esto significa que el compuesto es eléctricamente neutro.
Cuando el número de oxidación es positivo significa que los átomos del elemento tienden a transferir electrones, mientras que cuando es negativo significa que los átomos tienden a aceptar electrones.
Por último, aprendiste que antes de creer en algunas ideas con respecto a la composición de las sustancias, siempre debes investigar y corroborar las ideas de la ciencia.
Existen sustancias oxidantes a las que estás expuesto porque están presentes en el esmog, el humo de cigarro, bebidas alcohólicas, productos de limpieza y algunos residuos industriales cuyos efectos pueden ser muy nocivos para la salud.
Las propiedades redox de muchas de estas sustancias pueden provocar la muerte celular.
Para contrarrestar estos efectos es importante evitar hacer actividad física en espacios abiertos cuando la calidad del aire es mala, así como consumir alimentos con alto contenido en antioxidantes como frutas y verduras, por ejemplo, la vitamina C que se encuentra en los cítricos y la vitamina E que se encuentra en zanahorias, nueces y hortalizas.
También existen ácidos grasos insaturados que te protegen de estos daños; estos los puedes encontrar en los pescados de agua fría como el salmón y el bacalao o en productos adicionados con ácido docosahexaenoico.
El reto de hoy:
Para seguir aprendiendo, se te recomienda revisar la siguiente dirección electrónica:
http://objetos.unam.mx/quimica/estadosOxidacion/index.html
Otra dirección electrónica interesante relacionada con los números de oxidación y las reacciones redox es la siguiente:
https://es.khanacademy.org/science/ap-chemistry/chemical-reactions-ap
¡Buen trabajo!
Gracias por tu esfuerzo.
